Aldehyd oxidáza je enzým, ktorý štiepi aldehydy v stavovcoch. Nachádza sa v rôznych tkanivách cicavcov a ľudí. Presná funkcia aldehyd oxidázy nie je zatiaľ známa.
Čo je aldehyd oxidáza?
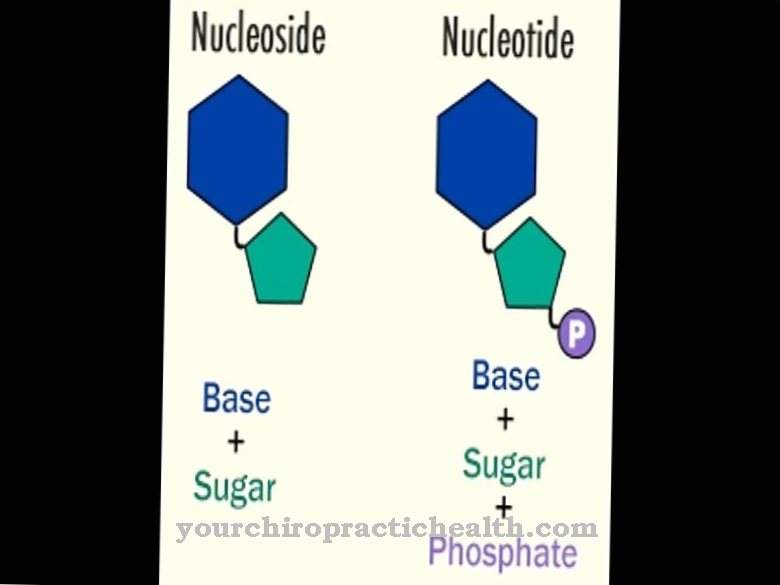
Aldehyd oxidáza (AOX1) pomáha pri enzymatickom rozklade aldehydov v tele. Zistilo sa však, že tiež štiepi nikotín na kotinín. Atóm kyslíka je zabudovaný do nikotínu bez kyslíka za vzniku aldehydovej štruktúry.
Z tohto dôvodu je aldehyd oxidáza tiež dôležitá pre metabolizmus tryptofánu a súčasne pre biotransformáciu. Nachádza sa hlavne v cytosóle pečeňových buniek, pankreasu, pľúc, kostrových svalov alebo tukových buniek. Kofaktor molybdén je veľmi dôležitý pre aktivitu enzýmu. V ľudskej DNA je iba jeden gén AOX, ktorý môže kódovať funkčný enzým. Niekoľko génov AOX je aktívnych v iných stavovcoch. Aldehyd oxidáza je veľmi podobná enzýmu xantín dehydrogenázy a je s ním príbuzná.
Oba enzýmy môžu premeniť hypoxantín na xantín absorpciou atómu kyslíka a molekuly vody. Konverzia xantínu na kyselinu močovú sa však uskutočňuje iba prostredníctvom xantínhydrogenázy (xantín oxidázy). Aldehyd oxidáza pozostáva z 1338 aminokyselín. Molybdopterín, FAD a 2 (2Fe2S) slúžia ako kofaktory pre svoju účinnosť. Reakcia už charakterizovaná týmto názvom charakterizuje konverziu aldehydov pridaním kyslíka a vody na karboxylové kyseliny a peroxid vodíka.
Funkcia, účinok a úlohy
Enzým aldehyd oxidáza katalyzuje niekoľko reakcií. Zvyčajne je zodpovedný za konverziu aldehydov na karboxylové kyseliny s prídavkom kyslíka a vody. Všeobecne aldehyd oxidáza sprostredkuje pridanie atómu kyslíka k substrátu.
Okrem iného katalyzuje aj premenu nikotínu na conitín. Preto tiež hrá hlavnú úlohu pri biotransformácii a metabolizme tryptofánu. Molybdén sa v týchto reakciách vždy vyžaduje ako kofaktor. V rámci biotransformácie premieňa xenobiotiká s aldehydovými skupinami na zodpovedajúce karboxylové kyseliny v reakcii fázy I. V reakcii fázy II je kyselina glukurónová pripojená k karboxylovým skupinám, aby sa zvýšila rozpustnosť vo vode, aby sa cudzia molekula prepláchla z tela.
Štrukturálne a chemicky je aldehyd oxidáza úzko spojená s homológnym enzýmom xantínhydrogenáza (xantín oxidáza). Nie je však známe, prečo je konverzia xantínu na kyselinu močovú s prídavkom kyslíka a vody katalyzovaná iba xantínoxidázou. Premena hypoxantínu na xantín je stále katalyzovaná oboma enzýmami. Ďalej je za adipogenézu (reprodukcia tukových buniek) zodpovedná aj aldehyd oxidáza.
Stimuluje sekréciu tkanivového hormónu adiponektínu. Adiponectin zase zvyšuje účinnosť inzulínu. V hepatocytoch adiponektín zasa inhibuje uvoľňovanie aldehyd oxidázy. Nedostatok aldehyd oxidázy (AOX1) tiež inhibuje export lipidov z buniek. Presná funkcia aldehyd oxidázy nie je ešte úplne objasnená.
Vzdelávanie, výskyt, vlastnosti a optimálne hodnoty
Aldehyd oxidáza sa nachádza hlavne v cytoplazme pečeňových buniek. Nachádza sa však aj v tukových bunkách, pľúcnom tkanive, kostrových svaloch a pankrease. To bolo zamieňané s homológnou xantín oxidázou.
Oba enzýmy majú podobnú štruktúru. Niekedy však katalyzujú rôzne reakcie. Oba enzýmy potrebujú na svoju funkciu rovnaké kofaktory. Sú to molybdopterín, FAD a 2 (2Fe2S). Aldehyd oxidáza však degraduje nielen aldehydy, ale je tiež zodpovedná za oxidáciu N-heterocyklických zlúčenín, ako je nikotín, na kotinín.
Choroby a poruchy
Spolu s xantín dehydrogenázou (xantín oxidáza) a sulfit oxidáza je aldehyd oxidáza závislá od kofaktora molybdénu. Molybdén je zabudovaný do molybdopterínu ako komplexný atóm a tvorí kofaktor molybdénu. V prípade nedostatku molybdénu tieto tri enzýmy fungujú zle.
Xantín dehydrogenáza katalyzuje rozklad xantínu na kyselinu močovú. Enzým enzým aldehyd oxidáza je do tohto procesu zapojený iba čiastočne, napríklad keď sa hypoxantín štiepi na xantín. Tu dokonca konkuruje xantín oxidáze. Preto neexistuje žiadny izolovaný nedostatok aldehyd oxidázy. Avšak aldehyd oxidáza podporuje rozklad katecholamínov. Sulfitová oxidáza je zodpovedná za rozklad aminokyselín obsahujúcich síru, ako je cysteín, taurín alebo metionín. Ak je tento enzým deficitný, siričitan sa už nekonvertuje na síran. Kvôli kofaktorovému molybdénu majú tieto tri enzýmy obvykle spoločný nedostatok.
Pre každý z týchto enzýmov sú samozrejme možné izolované defekty spôsobené mutáciami. Doteraz však nebol opísaný žiadny klinický obraz so špecifickým deficitom aldehyd oxidázy. Nedostatok molybdénu indukovaný nevyváženou stravou je veľmi zriedkavý. Môže sa to však stať pri parenterálnej výžive s nízkym obsahom molybdénu viac ako šesť mesiacov. V takýchto prípadoch sú časté tachypnoe, tachykardia, silné bolesti hlavy, nevoľnosť, vracanie, obštrukcia centrálnej tváre alebo kóma. Ďalej existujú neznášanlivosti určitých aminokyselín. Zvýšené koncentrácie siričitanov sa nachádzajú v moči, zatiaľ čo znížené hodnoty kyseliny močovej sa nachádzajú v krvi.
Ak nedostatok molybdénu pretrváva, môže to viesť k problémom s rozkladom aminokyselín obsahujúcich síru, alergiou na siričitany, vypadávaním vlasov, nízkou hladinou kyseliny močovej v krvi a problémami s plodnosťou. Väčšina symptómov je však spôsobená nedostatkom sulfitovej oxidázy a xantín dehydrogenázy. Tachykardia je pravdepodobne spôsobená zvýšenými hladinami adrenalínu alebo noradrenalínu (katecholamíny), pretože ich rozklad je oneskorený nedostatkom aldehyd oxidázy. Nedostatok molybdénu môže byť spôsobený stravou s nízkym obsahom molybdénu a zápalovými ochoreniami čriev, ako je Crohnova choroba, s malabsorpciou potravy.
Dedičný nedostatok kofaktora molybdénu v dôsledku narušenej syntézy molybdopterínu je fatálny, ak všetky tri enzýmy zlyhajú bez liečby.



.jpg)
.jpg)


.jpg)