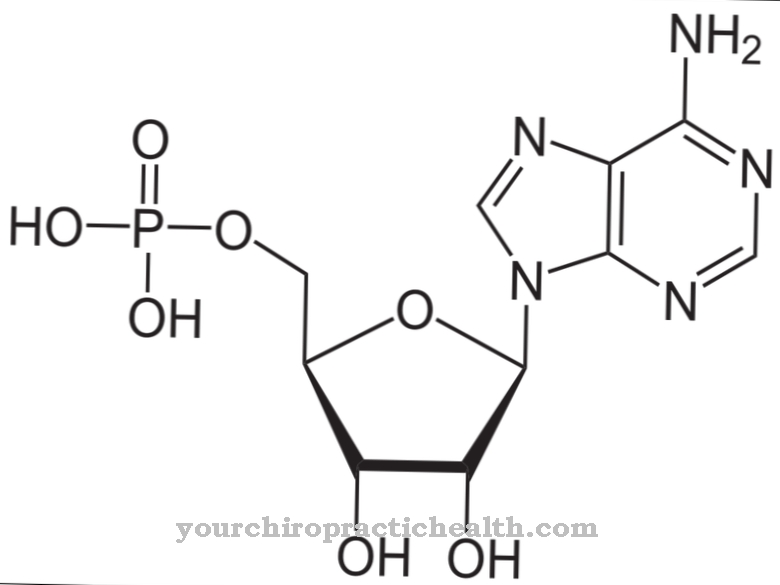
hydroxylysin je neklasická proteinogénna aminokyselina. Je inkorporovaný do zodpovedajúceho proteínu ako lyzín a hydrolyzovaný na hydroxylyzín v polypeptide pomocou enzýmu. Je to jedna z hlavných zložiek kolagénových proteínov v spojivovom tkanive.
Čo je to hydroxylyzín?
Hydroxylyzín je proteinogénna aminokyselina, ktorá sa najskôr inkorporuje do proteínu ako lyzín. Preto je to kanonická proteinogénna aminokyselina. Termín „kanonický“ znamená klasický.
Takže pre túto aminokyselinu neexistuje kodón. Hydroxylyzín sa nachádza hlavne v kolagéne spojivového tkaniva a v glykoproteínoch. Tam sa lyzín premieňa na hydroxylyzín enzymatickými procesmi. Iba časť lyzínu sa premieňa na hydroxylyzín. Vlastnosti príslušných kolagénov závisia od množstva hydrolyzovaných zvyškov lyzínu a prolínu.
Hydroxylyzín sa môže izolovať vo voľnej forme ako hydrochlorid. Hydrochlorid hydroxylyzínu je béžový prášok s teplotou topenia 225 až 230 stupňov. Je to zásaditá aminokyselina, ktorá tiež spôsobuje, že proteíny obsahujúce hydroxylyzín reagujú zásadite. Hydroxylyzín objavil americký biochemik a spoluzakladateľ „Clinical Chemistry“ Donald Van Slyke (1883-1971).
Funkcia, účinok a úlohy
Hydroxylyzín má veľký význam pre štruktúru spojivového tkaniva. Glykoproteíny tiež obsahujú hydroxylyzín, aby vytvorili glykozidové zlúčeniny proteínu s cukrovými zvyškami na hydroxylovom zvyšku.
V kolagéne je zodpovedný za zosieťovanie jednotlivých proteínových molekúl. Spolu s hydroxylprolínom, hydrolyzovanou formou prolínu, je tiež nápomocný pri budovaní terciárnych a kvartérnych štruktúr kolagénu. Hydroxylácia lyzínu je katalyzovaná enzýmom lyzylhydroxyláza za účasti kofaktorov iónov železa a kyseliny askorbovej (vitamín C). Distribučný vzorec hydroxylovaných zvyškov lyzínu v kolagéne nie je ani zvlášť tuhý, ani flexibilný. Vždy existujú opakujúce sa vzorce.
V proteíne sú však aj celé oblasti, ktoré neobsahujú žiadne hydroxylované zvyšky lyzínu. Zatiaľ čo hydroxyprolín je zodpovedný za špirálovú štruktúru kolagénu väzbou troch proteínových reťazcov, krížové väzby medzi rôznymi proteínovými molekulami sa tvoria prostredníctvom hydroxylových skupín hydroxylyzínu. Okrem toho tieto molekulové skupiny tiež slúžia ako väzobné miesto pre glykozidovú väzbu s cukrom. Celkovo to zaisťuje pevnosť spojivového tkaniva.
Ak je v proteínoch nedostatok hydroxylyzínu, nedá sa to napraviť dodatočným príjmom aminokyseliny. Neexistuje žiadny kodón pre voľný hydroxylyzín, takže sa nemôže začleniť do zodpovedajúceho proteínu. Hodnota doplnkov stravy s pridaným hydroxylyzínom je preto veľmi sporná. Preto musí byť nedostatok spôsobený nedostatočnou hydroxyláciou lyzínu.
Vzdelávanie, výskyt, vlastnosti a optimálne hodnoty
Hydroxylyzín sa vyskytuje iba v ľudskom a živočíšnom kolagéne. Existujú tiež niektoré glykoproteíny, ktoré tiež obsahujú hydroxylyzín. To zahŕňa adiponektín. Adiponektín je hormón, ktorý sa tvorí v tukovom tkanive a má rozhodujúci vplyv na účinnosť inzulínu. Hydroxylyzín sa tiež zistil u niektorých baktérií, ako je Staphylococcus aureus.
Distribúcia hydroxylovaného lyzínu nie je v kolagéne rovnomerná. Existujú miesta, kde sa takmer vždy nachádzajú. V iných oblastiach sa hydroxylyzín takmer nikdy nenachádza. Táto nerovnomerná distribúcia určuje štruktúru kolagénu. V štruktúre trojzávitnicovej štruktúry kolagénu je hydroxylyzín vždy umiestnený v polohe Y opakujúcej sa sekvencie Gly-X-Y. V krátkych oblastiach s nešroubovitou štruktúrou sa hydroxylyzín vyskytuje aj na iných miestach.
Choroby a poruchy
Spojivové tkanivo je úplne závislé od prítomnosti hydroxylyzínu. Kolagén môže byť stabilný a pevný iba vtedy, ak fungujú priečne väzby medzi molekulami proteínov. Nedostatok hydroxylyzínu spôsobuje slabosť spojivového tkaniva.
Ak je prítomný iba v extrémne malých množstvách alebo vôbec nie, zodpovedajúci organizmus by nebol životaschopný. Spojivové tkanivo už nemohlo plniť svoju úlohu obmedzujúceho a podporného tkaniva orgánov. V skutočnosti existujú choroby, ktoré možno vysledovať až po nedostatok hydroxylyzínu. Pretože táto aminokyselina je pôvodne inkorporovaná ako lyzín počas syntézy proteínov, nemôže to byť primárny nedostatok. Hydroxylyzín sa tvorí z lyzínu v kolagénovom proteíne pomocou lyzylhydroxyláz. Nedostatok hydroxylyzínu môže byť výsledkom iba defektu tohto enzýmu alebo jeho nedostatočnej funkcie.
Existuje skupina heterogénnych vrodených slabostí spojivového tkaniva, ktoré sa nazývajú Ehlers-Danlosov syndróm. Za tento klinický obraz môže byť zodpovedných niekoľko mutácií. Lyzylhydroxyláza môže byť okrem iného defektná, takže príliš málo lyzínu je hydroxylované. Ehlers-Danlosov syndróm sa prejavuje nadmernou natiahnuteľnosťou kože a nadmernou pohyblivosťou kĺbov. Ovplyvnené sú aj vnútorné orgány, krvné cievy, šľachy, väzy a svaly. Prognóza závisí od závažnosti poruchy. Ak ide o plavidlá, dá sa očakávať nepriaznivý priebeh. Úplné zlyhanie enzýmu lyzylhydroxylázy je nezlučiteľné so životom, a preto sa nepozoruje.
Ale aj pri neporušenom enzýme môže kvôli slabej aktivite existovať slabé spojivové tkanivo. Lyzylhydroxyláza vyžaduje ako kofaktory ióny železa a kyselinu askorbovú (vitamín C). Ak napríklad chýba vitamín C, vyskytuje sa to, čo sa nazýva skorbut. Scurvy je získané ochorenie spojivového tkaniva spôsobené nedostatkom hydroxylových skupín na zvyškoch kolagénu prolínu a lyzínu. Príčinou je nízka aktivita prolínhydroxylázy a lyzínhydroxylázy v dôsledku nedostatku kyseliny askorbovej.

.jpg)

.jpg)


.jpg)









.jpg)