fluór Výraz "halogén" znamená chemický prvok s atómovým číslom 9 a patrí k halogénom. Je to silne korozívny plyn, ktorý spôsobuje vážne poškodenie slizníc. Fluor sa používa na lekárske účely vo forme svojich solí, fluoridu, na posilnenie zubov.
Čo je fluór?
Fluór je vysoko leptavý a reaktívny plyn, nie je to zlúčenina, ale chemický prvok, ktorý patrí k halogénom. S atómovým číslom 9 je najľahší halogén. V prírode sa fluór vyskytuje hlavne vo forme svojich solí, fluoridov.
Plynný fluór nie je príliš stabilný a reaguje takmer so všetkými zlúčeninami a prvkami ihneď po jeho výrobe. Len pri héliu a neónovách vzácnych plynov nedochádza k žiadnej reakcii. Túto mimoriadne silnú reaktivitu možno vysvetliť jej veľmi silnou afinitou k elektrónom. Vždy odoberá elektróny od svojich reakčných partnerov, a preto je najsilnejším oxidačným činidlom. Názov fluór je odvodený z latinského „fluorescens“ (rieka). Ako fluorid vápenatý (fluorid) slúži ako tok pre rudy.
Ak sa fluorid pridáva do rúd, znižuje ich teplotu topenia, takže sa rýchlejšie stávajú tekutými. Z koncepčného hľadiska sa v medicíne používa pojem fluór genitalis pre bezsrstý výtok sekrécie z ženských genitálií. Génový fluór sa však nesmie zamieňať s fluórom.
Funkcia, účinok a úlohy
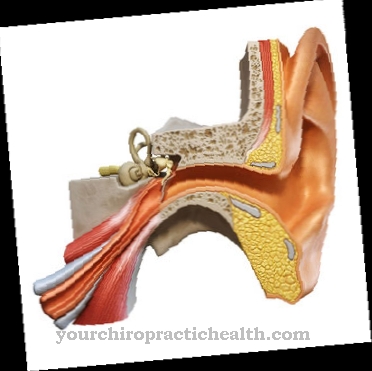
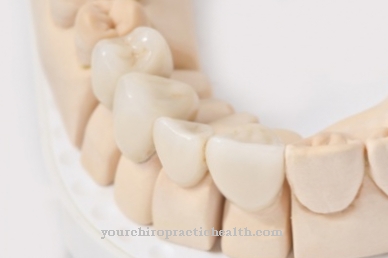
Fluór sa nazýva nevyhnutný stopový prvok. Dôležitosť fluóru je však kontroverzná. Je známe, že fluoridy majú ochranné vlastnosti proti zubom. Fluorid môže posilňovať zuby a súčasne inhibovať určité enzýmy baktérií kazu, ktoré spôsobujú rozklad uhľohydrátov.
Fluoridy pôsobia priamo na zub. Perorálne požitie fluoridu nemá žiadny vplyv na zuby. Zuby pozostávajú hlavne z minerálneho hydroxyapatitu. Hydroxyapatit môže byť napadnutý kyselinami, ktoré vznikajú rozkladom zvyškov potravín. Zlá dentálna hygiena preto často vedie k otvorom v zuboch, ktoré sú stále obsadené baktériami kazu. Napríklad, ak zubná pasta obsahuje fluorid, dochádza k výmene hydroxylových iónov za fluoridové ióny. To vytvára fluorapatit, ktorý sa javí ako tvrdší materiál a menej citlivý na kyseliny. Dokonca aj hydroxyapatit rozpustený v kyselinách sa môže znova zrážať ako fluoroapatit v prítomnosti fluoridov.
Počiatočné ničenie sa tak môže zvrátiť. Ale fluoridy majú tiež pozitívne vlastnosti pre stavbu kostí. Tu sa príjem uskutočňuje ústne. Deti a batoľatá dostávajú fluorid a vitamín D, aby sa zabránilo krivici. Fluorid by sa však nemal predávkovať, aby sa nemohla vyvinúť fluóza so zosilnením a zhrubnutím kĺbov. Zlúčeniny fluóru sú tiež schválené ako liečivá na osteoporózu. Zodpovedajúce tablety obsahujú fluorid sodný alebo fluorofosforečnan dvojsodný.
Vzdelávanie, výskyt, vlastnosti a optimálne hodnoty
Fluór je obsiahnutý vo forme fluoridov v čiernom a zelenom čaji, špargli a tiež v rybách. Mnoho solí obsahuje fluorid. Neexistujú žiadne čisté soli fluóru kvôli nízkej rozpustnosti zlúčenín obsahujúcich fluoridy vo vode. Fluorspar (fluorid vápenatý) a fluorapatit sú najbežnejšie v zemskej kôre.
Fluór sa vyrába hlavne z fluoridu vápenatého. Existujú dokonca aj organizmy, ktoré dokážu vyrobiť organofluórové zlúčeniny. Juhoafrický Gifblaar alebo rastliny rodu Dichapetalum môžu syntetizovať kyselinu fluóroctovú proti dravcom. Ľudský organizmus má dennú potrebu 0,25 až 0,35 mg.
Choroby a poruchy
Otrava súvisiaca s fluórom a zdravotné problémy sú však častejšie. Ako už bolo spomenuté, čistý fluór je veľmi jedovatý žieravý plyn. To tiež sťažuje výrobu fluóru.
Pretože reaguje s takmer všetkými materiálmi, môže sa tiež veľmi slabo skladovať a prepravovať. Pri otrave fluórom sa v pľúcach, na pokožke av očiach vyskytujú chemické popáleniny a popáleniny. V závislosti od dávky sa príslušné orgány rozpustia v krátkom čase, čo má za následok smrť. Letálna dávka je veľmi nízka a je 185 ppm. Otrava fluórom čistým fluórom sa zriedka vyskytne, pretože plyn nie je stabilný. Otrava fluorovodíkom je však rovnako nebezpečná. Fluorovodík vytvára vodíkové väzby s proteínmi v tele, čím sa ničí terciárna štruktúra proteínov. Uskutočňuje sa denaturácia bielkovín tela.
Fluoridy môžu vytvárať komplexné zlúčeniny s iónmi hliníka, ktoré majú podobný účinok ako fosforečnany. V tele tieto zlúčeniny zasahujú do fosforylačných reakcií. Okrem iného to vedie k deregulácii G proteínov, čím je inhibovaných mnoho enzýmov. Z tohto dôvodu nie je telu tolerovaná zvýšená dávka fluoridu. Užívanie príliš veľkého množstva fluoridových tabliet môže tiež viesť k nevoľnosti, zvracaniu a hnačke. Fluorid reaguje s žalúdočnou kyselinou, čím sa vytvára malé množstvo kyseliny fluorovodíkovej. To napáda sliznice. Chronické, mierne predávkovanie fluoridmi môže viesť k fluóze.
Fluoróza je chronická otrava fluórom so zmenami v štruktúre zubnej skloviny, kašľa, spúta a dýchavičnosti. Príliš veľa hydroxyapatitu sa v zuboch zmení na fluoroapatit. Zuby sú krehkejšie. Kosti sa tiež menia v dôsledku nadmernej tvorby fluorapatitu. Kosti pomaly stuhnú a prerobia sa. Ďalej je inhibovaná enzýmová enoláza.

.jpg)