Približne polovica všetkých proteínov je v ľudskom tele glykoproteíny, Látky zohrávajú úlohu ako bunkové zložky, ako aj imunitné látky. Tvoria sa hlavne ako súčasť takzvanej N-glykozylácie a ak nie sú správne zostavené, môžu spôsobiť vážne choroby.
Čo sú glykoproteíny?
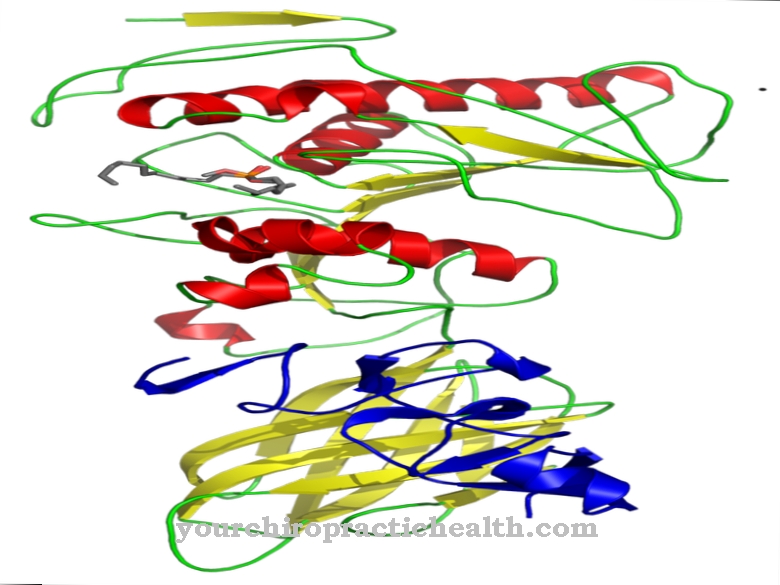
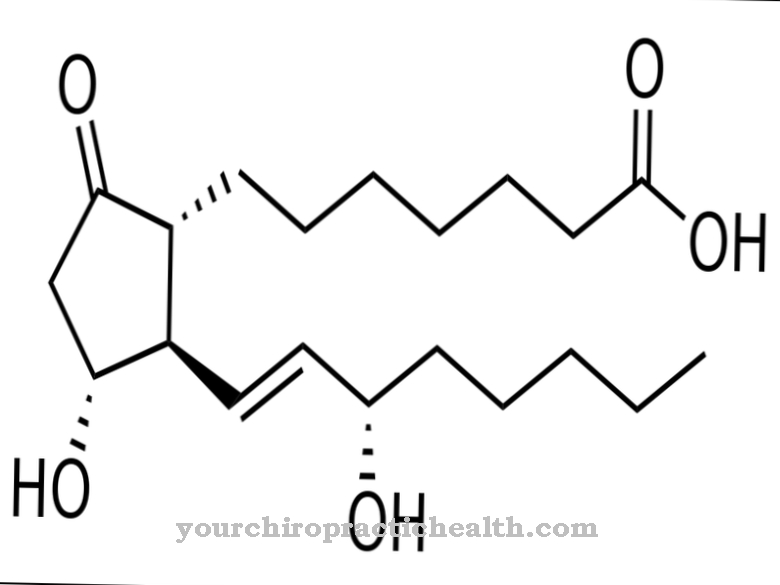
Glykoproteíny sú proteíny s rozvetvenými heteroglykánovými zvyškami podobnými stromu. Zvyčajne majú viskóznu konzistenciu. Makromolekuly obsahujú kovalentne viazané cukrové skupiny.
Pozostávajú z monosacharidov, ako je glukóza, fruktóza, manóza alebo acetylovaný amino cukor. Z tohto dôvodu sú známe aj ako oligosacharidy viazané na proteíny. Kovalentná väzba sa môže uskutočňovať rôznymi spôsobmi a zodpovedá buď väzbe na aminokyseliny serín alebo asparagín. Väzba na serín sa nazýva O- a to na asparagín N-glykozyláciu. Glykoproteíny zapojené do N-glykozylácie sa líšia veľkosťou. Zodpovedajú monosacharidom, di- alebo oligosacharidom a dokonca polysacharidom.
Podľa podielu monosacharidov sa delia na vysoko manózové, komplexné a hybridné glykoproteíny. V skupine bohatej na manózu prevažujú zvyšky manózy. V komplexnej skupine prevažujú sacharidy. Hybridná skupina je hybrid. Obsah uhľohydrátov v glykoproteínoch je medzi niekoľkými percentami pre ribonukleázy a až do 85 percent pre antigény krvných skupín.
Funkcia, účinok a úlohy
Glykoproteíny plnia v ľudskom organizme početné funkcie. Sú štruktúrnou zložkou bunkových membrán a v tomto kontexte sa tiež označujú ako štrukturálne proteíny. Nachádzajú sa tiež v hliene a používajú sa ako mazadlá v tekutinách.
Ako membránové proteíny prispievajú k bunkovej interakcii. Niektoré glykoproteíny majú tiež hormonálne funkcie, ako je rastový faktor hCG. Látky sú rovnako dôležité ako imunologické zložky vo forme imunoglobulínov a interferónov. Všetky exportné proteíny a membránové proteíny v tele boli stále glykoproteíny, aspoň počas biosyntézy. Obzvlášť sú dôležité pre rozpoznávacie reakcie v imunitnom systéme, pretože interagujú s imunologickými T-bunkami a receptormi T-buniek. V ľudskej krvnej plazme boli izolované rôzne plazmatické bielkoviny, z ktorých iba albumín a prealbumín neobsahujú žiadne zvyšky cukru.
Množstvo glykoproteínov je úžasné. Nakoniec takmer všetky extracelulárne rozpustné proteíny a enzýmy obsahujú zvyšky cukru. Ako hormóny majú glykoproteíny pleiotropný účinok, a preto sú rozhodujúce pre činnosť rôznych orgánových systémov. Hormóny TSH, HCG a FSH sú napríklad glykoproteíny. Ako membránové proteíny sú zastúpené v úlohe receptorov, ako aj transportérov a stabilizátorov. Majú stabilizačný účinok, najmä spolu s glykolipidmi. Spolu s týmito látkami tvoria tzv. Glykokalyx, ktorý stabilizuje bunky bez bunkovej steny.
Vzdelávanie, výskyt, vlastnosti a optimálne hodnoty
Najbežnejšou tvorbou glykoproteínov je N-glykozidická väzba alebo N-glykozylácia na asparagín. Cukor sa viaže na amidové skupiny bez dusíka. N-glykozylácia sa uskutočňuje v endoplazmatickom retikule. Takto vytvorené N-glykozidy sú najrelevantnejšou glykoproteínovou skupinou.
Pri N-glykozylácii prekurzor cukru snytetizuje na nosičovej molekule dolichol, nezávisle od aminokyselinovej sekvencie cieľového proteínu. Skupina OH na konci molekuly je spojená s difosfátom. Oligosacharidový prekurzor je tvorený na koncovom fosfátovom zvyšku molekúl. Prvých sedem cukrov sa zhromažďuje na cytosolovej strane. Dva N-acetylglukozamíny a päť zvyškov manózy sú pripojené k fosfátu dolicholínu. Ako donory sa javia nukleotidy cukru GDP-manóza a UDP-N-acetyl-glukozamín. Prekurzor je transportovaný cez ER membránu cez transportný proteín.
Prekurzor je teda orientovaný smerom dovnútra endoplazmatického retikula, do ktorého sú pridané štyri zvyšky manózy. Ďalej sa pestujú zvyšky glukózy. 14 prekurzor cukru dlhý je nakoniec prevedený na proteín. Ďalšou formačnou cestou pre glykoproteíny je O-glykozidická väzba alebo O-glykozylácia na serín, ktorá sa uskutočňuje v Golgiho aparáte buniek. Cukor je naviazaný na hydroxylovú skupinu serínu. Glykoproteínové hodnoty sú obzvlášť dôležité vo vzťahu k plazmatickým proteínom, pretože hrajú úlohu pri kompletnom krvnom obraze. Ak by sme v tomto bode vymenovali všetky normálne hodnoty glykoproteínov jednotlivo v tomto bode, prekročil by sa rozsah pôsobnosti.
Choroby a poruchy
Niektoré genetické choroby majú vplyv na glykozyláciu. Jednou skupinou takýchto chorôb je CDG. Glykoproteíny vykazujú abnormálne hodnoty. Dotknuté osoby trpia spomaleným vývojom, ktorý súvisí s fyzickými aj duševnými problémami.
Squint môže byť ďalším príznakom genetickej poruchy. Na tvorbe glokoproteínov sa podieľa celkom okolo 250 rôznych génov. V prípade vrodených glykozylačných porúch sú poruchy v pripájaní uhľovodíkových bočných reťazcov k proteínom spôsobené genetickou dispozíciou. V post-translačnej modifikácii dostávajú proteíny svoju plnú funkčnosť. V tomto procese, keď sú enzýmy alebo proteíny, ktoré vytvárajú uhľovodíkové bočné reťazce, abnormálne spojené, vytvorí sa CDG. N-glykozylácia je najčastejšie ovplyvnená poruchami. Doteraz bolo objavených okolo 30 enzýmových defektov, ktoré majú vplyv na N-glykozyláciu.
Poruchy genetickej O-glykozylácie sú o niečo zriedkavejšie. Prejavujú sa pri neuromuskulárnych ochoreniach viacerých systémov, ako je Walker-Warburgov syndróm. Pretože glykoproteíny preberajú v organizme toľko funkcií, klinický obraz je charakterizovaný rôznymi symptómami. Vrodené poruchy glykozylácie môžu byť postihnuté všetky orgány. Hlavnými príznakmi sú psychomotorické vývojové poruchy. Neurologické abnormality sú rovnako bežné. Poruchy koagulácie alebo endokrinné poruchy tiež nie sú zriedkavé.

.jpg)


.jpg)






.jpg)
.jpg)


.jpg)